St. Anna Kinderkrebsforschung: Immuntherapie gegen gefährliche virale Infektionen bei stammzelltransplantierten Kindern
- Virusspezifische Spender-T-Zellen werden in Zellkultur 12 Tage lang nach Stimulation mittels Viruspeptiden und Zytokinen ex vivo vermehrt.
- Virusspezifische T-Zell-Therapien zeigen ermutigende Ergebnisse bei der Behandlung lebensgefährlicher Virusinfektionen nach Stammzelltransplantation und Organtransplantation.
Pädiatrische Stammzelltransplantation
In Österreich erhalten pro Jahr etwa 40 Kinder und Jugendliche eine allogene hämatopoetische Stammzelltransplantation (HSZT). Dabei wird ein defektes oder maligne transformiertes hämatopoetisches System durch ein gesundes Spendersystem ersetzt. Das Spektrum pädiatrischer Krankheitsbilder, die durch eine HSZT geheilt werden können, ist breit gefächert und umfasst maligne (v. a. akute Leukämien) und nichtmaligne Erkrankungen (z. B. aplastische Anämien, Immundefekte, Sichelzellerkrankung, Thalassämien).Virusinfektion als Komplikation nach HSZT
Vor einer HSZT findet eine Konditionierung des Patienten mittels Chemotherapie und/oder Bestrahlung statt. Nach der HSZT muss das Immunsystem supprimiertwerden, um eine Graft-versus- Host-Erkrankung zu verhindern. Dadurch kann jedoch die Rekonstitution des Immunsystems nur langsam stattfinden, und der Patient muss in dieser Phase lange ohne T-Zell-vermittelte Immunabwehr auskommen. In der Folge können Infektionen entstehen, z. B. mit Adeno- (ADV), Cytomegalo- (CMV) oder Eppstein- Barr-Viren (EBV). ADV- und CMVdisseminierte Infektionen sind trotz antiviraler Behandlung mit einer Mortalitätsrate von 50–60 % assoziiert (Hiwarkar et al., BMT 2013; 48:803).
Klinische Manifestation des Adenovirus und Cytomegalovirus
Häufige klinische Manifestationen einer ADV- oder CMV-Infektion nach HSZT sind anhaltendes Fieber, hämorrhagische Zystitis, Enteritis, Pneumonie mit Dyspnoe und Hypoxie, Hepatitis, Encephalitis, bis hin zum letalen Multiorganversagen (Matthes-Martin et al., Transpl Infect Dis 2012; 14:555; und Ljungman et al., Clin Infect Dis 2014; 59:473).Präemptive antivirale Behandlung
mittels Virostatika
Da bei einer klinisch manifesten ADVund CMV-Infektion eine virostatische Therapie häufig den letalen Verlauf nicht verhindern kann, hat sich eine präemptive Vorgehensweise etabliert, in der unmittelbar nach Detektion von Viruspartikeln im Blut virostatisch behandelt wird (Matthes-Martin et al., Transpl Infect Dis 2012; 14:555). Im Wesentlichen handelt es sich dabei um Ganciclovir oder um das Purin-Analogon Cidofovir. Die Effektivität der präemptiven virostatischen Therapie im Zusammenhang mit Immunsuppression und Lymphopenie ist jedoch fraglich. Die Behandlung ist mit nephro- und myelotoxischen Nebenwirkungen verbunden, weshalb häufig eine aufwendige Supportivtherapie notwendig wird. Eine dauerhafte Kontrolle der Virusinfektionen kann in vielen Fällen erst durch eine kompetente virusspezifische Immunantwort erreicht werden.
Klinische Erfahrung mit Immuntherapien zur Behandlung viraler Infektionen
Es zeigte sich deutlich, dass die Präsenz virusspezifischer T-Zellen nach HSZT mit der Abnahme zirkulierender Viruspartikel und somit einem Rückgang der Infektion korreliert. Die zelluläre Immunantwort gegen Viren erfolgt über CD8+-zytotoxische T-Zellen in Kombination mit CD4+- Helfer-T-Zellen. Im letzten Jahrzehnt gab es einige Bemühungen, Zelltherapien gegen virale Infektionen zu etablieren. In Tübingen wurden Interferon gamma sezernierende virusspezifische T-Zellen magnetisch mittels Beads-gebundener Antikörper isoliert. In zwei Studien wurden 18 Patienten mit CMV-Virämie und 30 Patienten mit ADV-Virämie mit einer 83%igen bzw. 86%igen Ansprechrate behandelt (Feuchtinger et al., Blood 2010; 116:4360; und Feucht et al., Blood 2015; 125:1986). Eine alternative und ältere Strategie ist die Ex-vivo- Vermehrung virusspezifischer T-Zellen (VTZ) mittels Langzeit-Expansion (10–14 Wochen), wobei als Stimulus gentechnisch hergestellte antigenpräsentierende Zellen (APZ) verwendet werden. Auch hier zeigten Studien ein sehr gutes Ansprechen von ADV, CMV und EBV, mit nur geringer Inzidenz für eine Graft-versus- Host-Erkrankung (GvHD) > Grad II bis III (Tzannou et al., Clin Transl Immunology 2014; 3:e11). Nachteile dieser Methoden sind ihr hoher Preis, der beträchtliche Zeitaufwand und die Notwendigkeit einer zusätzlichen Spender-Leukapherese.Vereinfachung der Expansionsmethode:
Um der Ex-vivo-Expansion eine breitere Anwendung zu ermöglichen, verzichteten wir auf gentechnisch manipulierte APZ und stimulierten die Zellen stattdessen mit Antigenen in Form 15-mer langer Peptidpools. Diese werden über Major Histocompatibility Complex (MHC) von Monozyten an virusspezifische TZellen präsentiert. Wir benötigen nur100 ml Blut zur Isolation von Leukozyten, die zu Beginn der Kultur bzw. am Tag 6 mit virusspezifischen Peptidpools stimuliert werden. Durch Interleukin- 15-Zugabe wird die Proliferation weiter angeregt. Ein spezieller gaspermeabler Bioreaktor mit Silikonmembran erlaubt einen effizienten Gasaustausch und unterstützt die Vermehrung von CD8+- und CD4+-Memory-T-Zellen, die nach Kultur in unterschiedlichen Differenzierungsgraden vorliegen. Die Präsenz von Central Memory-T-Zellen garantiert eine lang anhaltende Immunität. Potenziell alloreaktive T-Zellen sterben während dieser 12-tägigen Expansion ab, wobei der gesamte Arbeitsaufwand bei nur 15 Arbeitsstunden liegt (Abb.). Mit derselben
Methode können kurzzeitexpandierte virusspezifische T-Zellen (k-VTZ) gegen ADV, CMV, EBV und Polyomavirus (BKV) produziert werden.
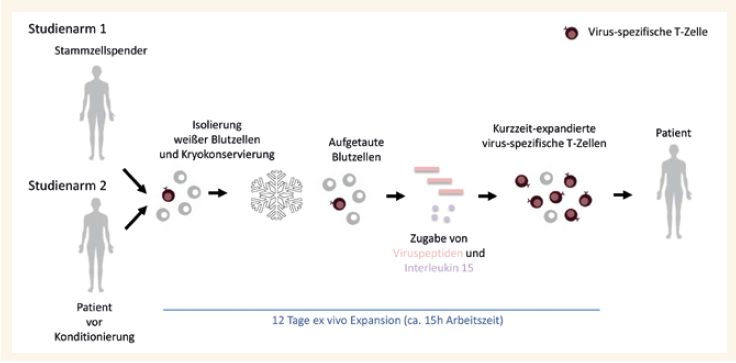
Abb.: Darstellung der ex vivo Kurzzeit-Expansion allogener (Studienarm 1) und autologer (Studienarm 2) Virus-spezifischer T-Zellen
Erste Behandlung mit kurzzeitexpandierten ADV-spezifischen T-Zellen (k- ATZ):
Eine in weiterer Folge verbesserte und im GMP-Labor durchgeführte Herstellung ermöglichte im Jahr 2012 erstmals die Behandlung zweier Patienten auf Heilversuchsbasis im St. Anna Kinderspital in Wien. Bei einem 4-jährigen Mädchen mit rezidivierendem Neuroblastom und einem einjährigen Buben mit therapieresistenter AML kam es nach HSZT trotz präemptiver virostatischer Therapie zu einem Anstieg der Virämie. Beide Kinder erhielten je eine Infusion von 104 k-ATZ/kg Körpergewicht. Bereits 20 bzw. 30 Tage nach der Gabe konnten ATZ in beiden Patienten nachgewiesen werden, welche in weiterer Folge bei der ersten Patientin zu einer kompletten Beseitigung und beim zweiten Patienten zu einer 1,5-log-Reduktion der Viruslast im Blut führte. Während die erste Patientin weder toxische Nebenwirkungen noch Anzeichen einer GvHD zeigte, entwickelte der zweite Patient bereits 10 Tage nach Infusion und beginnendem T-Zell-Engraftment eine therapieresistente GvHD der Haut, welche sich zu einer GvHD Grad IV manifestierte. Obwohl nicht eindeutig auszuschließen, spricht doch der frühe Zeitpunkt der aufgetretenen GvHD gepaart mit der Tatsache, dass ATZ erst 12 Tage nach den ersten GvHD-Anzeichen detektiert werden konnten, gegen einen kausalen Zusammenhang (Geyeregger et al., JIT 2014; 37:245). Mittlerweile gibt es bereits einige Forschungsgruppen, die an ähnlichen Kurzzeitexpansionsmethoden arbeiten. Eine erst kürzlich erschienene Arbeit aus Texas beschreibt die Behandlung eines Patienten mit ADV, zweier Patienten mit CMV und acht weiterer Patienten mit anderen Viren mittels k-VTZ. Hier wurden allerdings k-VTZ mit Peptidpools in Kombination mit IL-4 und IL-7 statt IL-15 expandiert. Generell lag die Ansprechrate bei 94 % ohne toxische Nebenwirkungen, außer einer behandelbaren GvHD II, was die Sicherheit solcher Immuntherapien bestätigt (Papadopoulou et al., Sci Transl Med 2014; 6:242ra83).Studiendesign zur autologen und allogenen Behandlung mit k-VTZ:
Die Exvivo-Expansion von Zellen stellt eine substanzielle Manipulation dar, und die Produkte werden den „Arzneimitteln neuartiger Therapien“ (ATMP) zugeordnet. Deshalb bedurfte es noch drei weiterer Jahre Vorarbeit, bis wir im Mai 2015 die Herstellungserlaubnis von der AGES erhielten und die klinische Studie „Virus-Specific ImmunoTherapy (VISIT)“ im Juni 2016 starten konnten (EUDRA-CT nr: 2013-002492-17 or ClinicalTrials.gov: NCT02702427). Das Studiendesign sieht die k-VTZ Behandlung (Dosis: Einmalige Gabe von 5x103 k-VTZ/kg Körpergewicht) von ca. 15-20 Patienten vor, welche zuvor trotz zweiwöchiger Therapie mit Virostatika eine ADV und/oder CMV Virämie entwickelten . Sofern der Patient an einer zweiten viralen Infektion leidet, werden abermals 5x103 k-VTZ/kg gegen diesen Virus verabreicht. Alle Patienten unterliegen einem engmaschigen Virus Monitoring.Was wenn der Stammzellenspender keine entsprechenden VTZ hat?
Um auch Patienten behandeln zu können, deren hämatopoetischer Stammzellspender über keine nachweisbaren CMV-spezifischen T-Zellen verfügt, wurde die Studie um einen Arm erweitert (Abb.). Bei einem CMV IgG- und folglich CMV-spezifisch T-Zell negativen Spender für einen CMV IgG seropositiven Patienten werden dem letzteren bereits vor der Konditionierung 100ml Blut zur Isolierung weißer Blutzellen entnommen, welche für eine spätere T-Zellproduktion eingefroren werden. Sofern der Patient nach HSZT eine CMV-Virämie entwickelt, werden autologe CMV-spezifische T-Zellen hergestellt und dem Patienten infundiert. Dieser Ansatz stellt die weltweit erste Behandlung von HSZT-Patienten mittels autologer CMV-spezifischer T-Zellen dar.Behandlung viraler Infektionen von HSZT- und organtransplantierten Patienten mit Third-Party T-Zell Therapie
Eine weitere Behandlungsmöglichkeit ist die Gabe sogenannter Third-Party T-Zellen (nicht vom Stammzellspender), obwohl hierbei von einem höheren Risiko einer GvHD oder einer Abstoßung durch patienteneigene T-Zellen auszugehen ist. Allerdings zeigte sich in einer Studie mit 50 Patienten mit refraktärer Virämie, dass zumindest die Gabe von aufwendig über Wochen expandierten VTZ, zu einer partiellen oder sogar kompletten Immunantwort in 74% der Patienten führte, ohne dass eine gefährliche GvHD >Grad I zu beobachtet wurde (Leen et al., Blood 2013, 121, 5113).Ein weiteres Einsatzgebiet für VTZ sind Patienten mit viralen Problemen nach Organtransplantation. Auf Grund der lebenslang notwendingen Immunsuppression kann es auch hier zu lebensbedrohlichen Infektionen kommen. In einer Phase II Studie wurden 31 Patienten nach Organtransplantation mit EBV-spezifischen T-Zellen von Third-Party Spendern gegen EBV-induzierte posttransplant lymphoproliferative Erkrankung (PTLD) behandelt, ohne dass nennenswerte toxische Nebenwirkungen oder eine Transplantatsabstoßung auftraten. Die Ansprechrate lag nach 5 Wochen bei 64% und nach 6 Monaten bei 52% (Haque et al. Blood 2007; 110: 1123). Gerade die Expression von EBV-Antigenen bei etwa 40% aller Hodgking- oder non-Hodgking-Lymphome ermöglichte auch hier die Behandlung rezidivierender Patienten mit autologen Langzeit-expandierten VTZ (Bollard et al., J Clin Oncol 2014; 32: 798). Bei Lungentransplantierten liegt die induzierte Mortalitätsrate, verursacht durch eine CMV Infektion, bei ca. 2-12% (Fishman et al., NEJM, 1998, 337, 1741). Bei Nierentransplantierten wiederum führen besonders BKV Infektionen in 30-60% zu einem Transplantatsverlust (Dall et al., Clin J Am Soc Nephrol, 2008, S68). Studien zur Behandlung von CMV und BKV Infektionen bei Lungen bzw. Nieren transplantierten Patienten mit VTZ liegen bis lang noch nicht vor.
Zukunftsaussichten
Die Herstellung von k-VTZ ermöglicht in Zukunft eine breite Anwendung bei stammzell- und organtransplantierten Patienten. Zusätzlich besteht auch die Möglichkeit zur Behandlung EBV-induzierter Tumorerkrankungen. Vielversprechend scheinen auch Behandlungen mittels „off the shelf“ Third Party T-Zellen, deren Nebenwirkungen und Wirkung (abhängig von Dosis und HLA-Kompatibilität) noch in weiteren Studien untersucht werden müssen. Daher erscheint besonders die Kombination von Third-Party k-VTZ gegen mehrere Viren als durchaus erfolgversprechend für die Zukunft.
Artikel ©: SPECTRUM ONKOLOGIE 1/2017
Teilen










