Klinische Zellbiologie & FACS Core Unit
Nach Gründung des Forschungsinstituts wurde das Stammzell-Labor als letztes der ursprünglich 5 Forschungseinheiten Ende 1989 bezogen. Erstes Ziel war die durchfluss-zytometrische Analyse der blutbildenden Stammzellen, die bei der Regeneration der Blutzellen nach einer Chemotherapie eine wichtige Rolle spielen und auch als klinischer Indikator verwendet werden. Bereits nach einem Jahr konnten wir diese Stammzellen aus Patientenblut isolieren und anreichern und somit erstmals mikroskopisch sichtbar machen. Untersuchungen von Knochenmark, Blut und Nabelschnurblut zeigten, dass diese Materialien nicht nur unterschiedlich viele, sondern vor allem jeweils typische Stammzell-Subtypen enthalten (Fritsch et al. 1993; Fritsch et. al. 1995; Fritsch et al. 1996).
Eine Studie belegte, dass sich Stammzellen aus mobilisiertem Blut besonders gut für die Transplantation eignen (Fritsch et al. 1994). Die durchfluss-zytometrische (FACS) Zellanalyse wurde optimiert, sodass ab 1996 die 4-Farben FACS Routine zur Verfügung stand. Diese durchfluss-zytometrischen Analyseverfahren wurden mit den Jahren immer weiter verbessert und auf die gleichzeitige Messung von aktuell bis zu 11 verschiedenen Farben ausgeweitet. Neben den Stammzellen und deren Subtypen werden längst auch alle Arten der weißen Blutzellen routinemäßig analysiert und die Ergebnisse der Klinik zur Verfügung gestellt. Aus ursprünglichen Experimenten zur Anreicherung und Reinigung von Stammzellen für einen klinischen Einsatz wurde 1996 die positive Stammzell-Selektion und ab 2003 die Lymphozyten Depletion, was die Stammzellentransplantation über HLA-Barrieren hinweg ermöglichte (Fritsch et al. 2000).
Mit Beginn der therapeutischen Stammzellsammlung übernahm das Labor auch die Kryokonservierung von autologen Stammzellen und von Spenderzellen für die allogene Zellspende samt dazu gehöriger Logistik. In enger Zusammenarbeit mit Ärzten und Wissenschaftlern wurden viele Methoden in der klinischen Anwendung optimiert, wie das Monitoring der hämatopoetischen Regeneration (Fritsch et al. 1999; Pichler et al. 2002), die standardisierte Quantifizierung von Stammzellen (Fritsch et al. 1997; Fritsch et al. 2012), die Steuerung des Chimärismus im transplantierten Patienten (Lion et al. 2001; Matthes-Martin et al. 2001; Matthes-Martin et al. 2003), oder die Optimierung der Sammeleffizienz bei der Zellapherese (Witt et al. 2007; Witt et al. 2011).
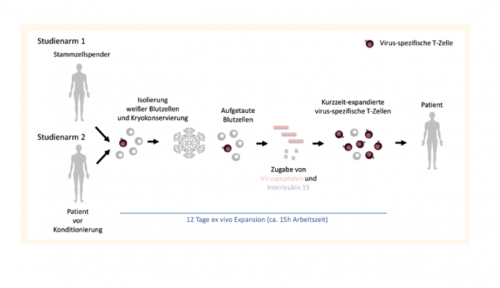
Aktuelle Aktivitäten konzentrieren sich auf den Nachweis und die Anreicherung virusspezifischer Immunzellen (Geyeregger et al. 2013) und auf neue Methoden der adoptiven Immuntherapie, um lebensbedrohliche virale Infekte im Rahmen der Stammzellentransplantation behandeln zu können. Alle zelltherapeutischen Arbeiten des klinischen Labors laufen seit der Betriebsbewilligung des Bundesministeriums (2004) unter GMP Bedingungen im Reinraum ab. Wir unterziehen uns regelmäßigen Inspektionen durch die AGES und arbeiten nach den Vorgaben des Gewebesicherheitsgesetzes und des Arzneimittelgesetzes.
Eine Studie belegte, dass sich Stammzellen aus mobilisiertem Blut besonders gut für die Transplantation eignen (Fritsch et al. 1994). Die durchfluss-zytometrische (FACS) Zellanalyse wurde optimiert, sodass ab 1996 die 4-Farben FACS Routine zur Verfügung stand. Diese durchfluss-zytometrischen Analyseverfahren wurden mit den Jahren immer weiter verbessert und auf die gleichzeitige Messung von aktuell bis zu 11 verschiedenen Farben ausgeweitet. Neben den Stammzellen und deren Subtypen werden längst auch alle Arten der weißen Blutzellen routinemäßig analysiert und die Ergebnisse der Klinik zur Verfügung gestellt. Aus ursprünglichen Experimenten zur Anreicherung und Reinigung von Stammzellen für einen klinischen Einsatz wurde 1996 die positive Stammzell-Selektion und ab 2003 die Lymphozyten Depletion, was die Stammzellentransplantation über HLA-Barrieren hinweg ermöglichte (Fritsch et al. 2000).
Mit Beginn der therapeutischen Stammzellsammlung übernahm das Labor auch die Kryokonservierung von autologen Stammzellen und von Spenderzellen für die allogene Zellspende samt dazu gehöriger Logistik. In enger Zusammenarbeit mit Ärzten und Wissenschaftlern wurden viele Methoden in der klinischen Anwendung optimiert, wie das Monitoring der hämatopoetischen Regeneration (Fritsch et al. 1999; Pichler et al. 2002), die standardisierte Quantifizierung von Stammzellen (Fritsch et al. 1997; Fritsch et al. 2012), die Steuerung des Chimärismus im transplantierten Patienten (Lion et al. 2001; Matthes-Martin et al. 2001; Matthes-Martin et al. 2003), oder die Optimierung der Sammeleffizienz bei der Zellapherese (Witt et al. 2007; Witt et al. 2011).
Aktuelle Aktivitäten konzentrieren sich auf den Nachweis und die Anreicherung virusspezifischer Immunzellen (Geyeregger et al. 2013) und auf neue Methoden der adoptiven Immuntherapie, um lebensbedrohliche virale Infekte im Rahmen der Stammzellentransplantation behandeln zu können. Alle zelltherapeutischen Arbeiten des klinischen Labors laufen seit der Betriebsbewilligung des Bundesministeriums (2004) unter GMP Bedingungen im Reinraum ab. Wir unterziehen uns regelmäßigen Inspektionen durch die AGES und arbeiten nach den Vorgaben des Gewebesicherheitsgesetzes und des Arzneimittelgesetzes.
Referenzen
[1] Fritsch G, Buchinger P, Printz D, Fink FM, Mann G, Peters C, Wagner T, Adler A, Gadner H (1993) Rapid discrimination of early CD34+ myeloid progenitors using CD45-RA analysis. Blood 81:2301-2309
[2] Fritsch G, Stimpfl M, LeitnerA, Printz D, Buchinger P, Mann G, Peters C, Zoubek A, Gadner H (1995) Phänotypische Unterschiede zwischen den CD34 positiven Zellen in verschiedenen Transplantations-Materialien. Klin Päd 207:211-214
[3] Fritsch G, Stimpfl M, Kurz M, Printz D, Buchinger P, Fischmeister G, Höcker P, Gadner H (1996) The composition of CD34 sub populations differs between bone marrow, blood and cord blood. Bone Marrow Transplant 17:169-178
[4] Fritsch G, Fischmeister G, Haas OA, Peters C, Gadner H, Strobl H, Höcker P, Kurz M (1994) Peripheral blood hemopoietic progenitor cells of cytokine-stimulated healthy donors as an alternative for allogeneic transplantation (Letter). Blood 83:3420-3421
[5] Fritsch G, Scharner D, Fröschl G, Buchinger P, Peters C, Matthes S, Witt V, Gadner H (2000) Selection of CD34 positive blood cells for allogeneic transplantation: approaches to optimise CD34 cell recovery, purity, viability and T cell depletion. Onkologie 23:449-456.
[6] Fritsch G, Witt V, Dubovsky J, Matthes S, Peters C, Buchinger P, Printz D, Handgretinger R, Lion T, Gadner H (1999) Flow cytometric monitoring of hematopoietic reconstitution in myeloablated patients following allogeneic transplantation. Cytotherapy 1 (4):295-309.
[7] Pichler J, Printz D, Scharner D, Trbojevic D, Siekmann J , Fritsch G (2002) Improved flow cytometric method to enumerate residual cells: Minimal linear detection limits for platelets, erythrocytes and leukocytes Cytometry 50:231-237
[8] Fritsch G, Printz D, Stimpfl M, Dworzak MM, Witt V, Pötschger U, Buchinger P (1997): Quantitative CD34 analysis: Comparison of methods. Transfusion 37:775-784
[9] Fritsch G, Witt V, Pichler J, Spengler HP, Scharner D, Zipperer E, Trbojevic D, Stemberger J, Geyeregger R, Tea M K M, PrintzD. (2012) Robust multi-parameter single-platform quantification of myeloid and B-lymphoid CD34 progenitor cells in all clinical CD34 cell sources and in thawed PBSC. Ped Hematol 29:595-610
[10] Lion T, Daxberger H, Dubovsky J, Filipcik P, Fritsch G, Printz D, Peters C, Matthes-Martin S, Lawitschka A, Gadner H (2001) Analysis of chimerism within specific leukocyte subsets for detection of residual or recurrent leukemia in pediatric patients after allogeneic stem cell transplantation. Leukemia 15:307-310
[11] Matthes-Martin S, Fritsch G, Peters C, Lawitschka A, Lion T, Kronberger M, Pötschger U, Gadner H (2001) Lineage-specific chimerism in FACS-sorted leukocytes after allogeneic pediatric SCT: impact of conditioning regimen and T cell depletion, and correlation with late rejection . Blood 98: 379a (ASH abstract)
[12] Matthes-Martin S, Lion T, Haas OA, Frommlet F, Daxberger H, König M, Printz D, Scharner D, Eichstill C, Peters C, Lawitschka A, Gadner H and Fritsch G (2003) Lineage-specific chimaerism after stem cell transplantation in children following reduced intensity conditioning: Potential predictive value of NK cell chimaerism for late graft rejection. Leukemia, 17:1934-1942
[13] Witt V, Beiglböck E, Ritter R, Würth M, Peters C, Ladenstein R, Gadner H, Fritsch G. 2007 Performance of a new separator system for routine autologous hematopoietic progenitor cell collection in small children. J Clin Apher 22(6) 306-313.
[14] Witt V, Beigelböck E, Fritsch G Bone marrow peocessing with the AMICUSTM separator system. J Clin Apher. 2011;26(4):195-9.
[15] Geyeregger R, Freimüller C, Stevanovic S, Stemberger J, Mester G, Dmytrus J, Lion T, Rammensee H-G, Fischer G, Eiz-Vesper B, Lawitschka A, Matthes S, and Fritsch G Twelve-day generation of functional multi-virus-specific T cells potentially useful for broad clinical application Plos One 2013, 8(4):e59592
[1] Fritsch G, Buchinger P, Printz D, Fink FM, Mann G, Peters C, Wagner T, Adler A, Gadner H (1993) Rapid discrimination of early CD34+ myeloid progenitors using CD45-RA analysis. Blood 81:2301-2309
[2] Fritsch G, Stimpfl M, LeitnerA, Printz D, Buchinger P, Mann G, Peters C, Zoubek A, Gadner H (1995) Phänotypische Unterschiede zwischen den CD34 positiven Zellen in verschiedenen Transplantations-Materialien. Klin Päd 207:211-214
[3] Fritsch G, Stimpfl M, Kurz M, Printz D, Buchinger P, Fischmeister G, Höcker P, Gadner H (1996) The composition of CD34 sub populations differs between bone marrow, blood and cord blood. Bone Marrow Transplant 17:169-178
[4] Fritsch G, Fischmeister G, Haas OA, Peters C, Gadner H, Strobl H, Höcker P, Kurz M (1994) Peripheral blood hemopoietic progenitor cells of cytokine-stimulated healthy donors as an alternative for allogeneic transplantation (Letter). Blood 83:3420-3421
[5] Fritsch G, Scharner D, Fröschl G, Buchinger P, Peters C, Matthes S, Witt V, Gadner H (2000) Selection of CD34 positive blood cells for allogeneic transplantation: approaches to optimise CD34 cell recovery, purity, viability and T cell depletion. Onkologie 23:449-456.
[6] Fritsch G, Witt V, Dubovsky J, Matthes S, Peters C, Buchinger P, Printz D, Handgretinger R, Lion T, Gadner H (1999) Flow cytometric monitoring of hematopoietic reconstitution in myeloablated patients following allogeneic transplantation. Cytotherapy 1 (4):295-309.
[7] Pichler J, Printz D, Scharner D, Trbojevic D, Siekmann J , Fritsch G (2002) Improved flow cytometric method to enumerate residual cells: Minimal linear detection limits for platelets, erythrocytes and leukocytes Cytometry 50:231-237
[8] Fritsch G, Printz D, Stimpfl M, Dworzak MM, Witt V, Pötschger U, Buchinger P (1997): Quantitative CD34 analysis: Comparison of methods. Transfusion 37:775-784
[9] Fritsch G, Witt V, Pichler J, Spengler HP, Scharner D, Zipperer E, Trbojevic D, Stemberger J, Geyeregger R, Tea M K M, PrintzD. (2012) Robust multi-parameter single-platform quantification of myeloid and B-lymphoid CD34 progenitor cells in all clinical CD34 cell sources and in thawed PBSC. Ped Hematol 29:595-610
[10] Lion T, Daxberger H, Dubovsky J, Filipcik P, Fritsch G, Printz D, Peters C, Matthes-Martin S, Lawitschka A, Gadner H (2001) Analysis of chimerism within specific leukocyte subsets for detection of residual or recurrent leukemia in pediatric patients after allogeneic stem cell transplantation. Leukemia 15:307-310
[11] Matthes-Martin S, Fritsch G, Peters C, Lawitschka A, Lion T, Kronberger M, Pötschger U, Gadner H (2001) Lineage-specific chimerism in FACS-sorted leukocytes after allogeneic pediatric SCT: impact of conditioning regimen and T cell depletion, and correlation with late rejection . Blood 98: 379a (ASH abstract)
[12] Matthes-Martin S, Lion T, Haas OA, Frommlet F, Daxberger H, König M, Printz D, Scharner D, Eichstill C, Peters C, Lawitschka A, Gadner H and Fritsch G (2003) Lineage-specific chimaerism after stem cell transplantation in children following reduced intensity conditioning: Potential predictive value of NK cell chimaerism for late graft rejection. Leukemia, 17:1934-1942
[13] Witt V, Beiglböck E, Ritter R, Würth M, Peters C, Ladenstein R, Gadner H, Fritsch G. 2007 Performance of a new separator system for routine autologous hematopoietic progenitor cell collection in small children. J Clin Apher 22(6) 306-313.
[14] Witt V, Beigelböck E, Fritsch G Bone marrow peocessing with the AMICUSTM separator system. J Clin Apher. 2011;26(4):195-9.
[15] Geyeregger R, Freimüller C, Stevanovic S, Stemberger J, Mester G, Dmytrus J, Lion T, Rammensee H-G, Fischer G, Eiz-Vesper B, Lawitschka A, Matthes S, and Fritsch G Twelve-day generation of functional multi-virus-specific T cells potentially useful for broad clinical application Plos One 2013, 8(4):e59592