Zelluläre Therapien
Die Forschungsgruppe zur Entwicklung zellulärer Therapeutika wurde 2012 am CCRI eingerichtet. Vorrangiges Ziel der Forschungsgruppe ist die Entwicklung einer Tumortherapie, basierend auf der Verabreichung von T-Zellen, welche ex vivo vermehrt und dann mit chimären Antigenrezeptoren (CARs) zur Erkennung von Tumorzellen ausgestattet werden.
Diese CAR-basierte Strategie gehört zu den vielversprechendsten Formen der zellulären Immuntherapie. Ihr enormes Potential zeigte sich erst kürzlich in klinischen Studien an Patienten mit hochmalignen Formen der lymphatischen Leukämie und des Melanoms, in denen in eindrucksvoller Weise Tumorrückbildung und wahrscheinlich sogar Heilung erreicht werden konnte. Trotz dieser Ergebnisse befindet sich diese Strategie immer noch in einem experimentellen Stadium und benötigt eine Verbesserung der Wirksamkeit sowie eine Vermeidung von toxischen Autoimmunerkrankungen.
Unsere zelltherapeutische Gruppe komplementiert am CCRI die Erforschung neuer Therapiemöglichkeiten mit dem Ziel der klinischen Etablierung dieses Therapieansatzes basierend auf modifizierten T-Zellen. Dabei konzentrieren wir uns zunächst auf das Ewing Sarkom, dem zweithäufigsten Knochentumor in Kindern und jungen Erwachsenen. In ersten Vorarbeiten entwickelten wir dazu einen neuen Rezeptor zur Einschleusung in die T-Zellen, damit diese die Ewing Sarkom-Zellen über sogenannte „Streß-induzierte“ Proteine erkennen können. Dieses Erkennungsprinzip und sein spezieller Aufbau bieten besondere Vorteile und in unseren Vorarbeiten konnten wir inzwischen zeigen, daß T-Zellen mit Hilfe dieses Rezeptors Ewing Sarkom-Zellen tatsächlich hocheffizient erkennen und abtöten können. Aufgrund dieser ersten Ergebnisse wollen wir die Wirksamkeit unseres Ansatzes in einem präklinischen Modell testen als Voraussetzung für eine spätere klinische Anwendung.
Die Ausstattung der T-Zellen mit einem Rezeptor zur Erkennung der Krebszellen betrachten wir als einen ersten Schritt. Wir halten es aber für ebenso wichtig, die Wirksamkeit und Sicherheit der Zellen zu erhöhen. Dazu wollen wir in begleitenden Projekten die Zellen mit zusätzlichen Funktionen ausstatten mit dem Ziel hocheffiziente, steuerbare und zielsichere T-Zellen zu generieren.
Die Immuntherapie basierend auf modifizierten T-Zellen ist auch attraktiv für eine Therapie von Infektionen mit dem Cytomegalovirus (CMV), die in Patienten nach Stammzelltransplantation häufig sehr schwerwiegende Komplikationen auslösen. Normalerweise geschieht eine Vermehrung von Virus-spezifischen T-Zellen im Körper. In transplantierten Patienten findet dies allerdings häufig nicht oder nur ungenügend statt v.a. wenn der Stammzell-Spender noch keinen Kontakt mit dem Virus hatte und somit die Frequenz von Virus-spezifischen Vorläufer-Zellen sehr gering ist. Eine Strategie zur Vermehrung Virus-spezifischer T-Zellen bei ausreichender Vorläufer-Frequenz konnte in unserem Institut erfolgreich etabliert werden (Gruppe Klinische Zellbiologie). Für die Situation, wo die Vermehrung Virus-spezifischer Vorläufer-Zellen nicht möglich ist, wollen wir in Analogie zu unserem Ansatz bei der Tumortherapie die T-Zellen mittels eines speziellen Rezeptors gegen CMV-infizierte Zellen richten. Ein derartiger Rezeptor, den wir in enger Kooperation mit einer Arbeitsgruppe am Institut für Virologie in Erlangen in Deutschland entwickelten, soll im nächsten Schritt präklinisch getestet werden.
Diese CAR-basierte Strategie gehört zu den vielversprechendsten Formen der zellulären Immuntherapie. Ihr enormes Potential zeigte sich erst kürzlich in klinischen Studien an Patienten mit hochmalignen Formen der lymphatischen Leukämie und des Melanoms, in denen in eindrucksvoller Weise Tumorrückbildung und wahrscheinlich sogar Heilung erreicht werden konnte. Trotz dieser Ergebnisse befindet sich diese Strategie immer noch in einem experimentellen Stadium und benötigt eine Verbesserung der Wirksamkeit sowie eine Vermeidung von toxischen Autoimmunerkrankungen.
Unsere zelltherapeutische Gruppe komplementiert am CCRI die Erforschung neuer Therapiemöglichkeiten mit dem Ziel der klinischen Etablierung dieses Therapieansatzes basierend auf modifizierten T-Zellen. Dabei konzentrieren wir uns zunächst auf das Ewing Sarkom, dem zweithäufigsten Knochentumor in Kindern und jungen Erwachsenen. In ersten Vorarbeiten entwickelten wir dazu einen neuen Rezeptor zur Einschleusung in die T-Zellen, damit diese die Ewing Sarkom-Zellen über sogenannte „Streß-induzierte“ Proteine erkennen können. Dieses Erkennungsprinzip und sein spezieller Aufbau bieten besondere Vorteile und in unseren Vorarbeiten konnten wir inzwischen zeigen, daß T-Zellen mit Hilfe dieses Rezeptors Ewing Sarkom-Zellen tatsächlich hocheffizient erkennen und abtöten können. Aufgrund dieser ersten Ergebnisse wollen wir die Wirksamkeit unseres Ansatzes in einem präklinischen Modell testen als Voraussetzung für eine spätere klinische Anwendung.
Die Ausstattung der T-Zellen mit einem Rezeptor zur Erkennung der Krebszellen betrachten wir als einen ersten Schritt. Wir halten es aber für ebenso wichtig, die Wirksamkeit und Sicherheit der Zellen zu erhöhen. Dazu wollen wir in begleitenden Projekten die Zellen mit zusätzlichen Funktionen ausstatten mit dem Ziel hocheffiziente, steuerbare und zielsichere T-Zellen zu generieren.
Die Immuntherapie basierend auf modifizierten T-Zellen ist auch attraktiv für eine Therapie von Infektionen mit dem Cytomegalovirus (CMV), die in Patienten nach Stammzelltransplantation häufig sehr schwerwiegende Komplikationen auslösen. Normalerweise geschieht eine Vermehrung von Virus-spezifischen T-Zellen im Körper. In transplantierten Patienten findet dies allerdings häufig nicht oder nur ungenügend statt v.a. wenn der Stammzell-Spender noch keinen Kontakt mit dem Virus hatte und somit die Frequenz von Virus-spezifischen Vorläufer-Zellen sehr gering ist. Eine Strategie zur Vermehrung Virus-spezifischer T-Zellen bei ausreichender Vorläufer-Frequenz konnte in unserem Institut erfolgreich etabliert werden (Gruppe Klinische Zellbiologie). Für die Situation, wo die Vermehrung Virus-spezifischer Vorläufer-Zellen nicht möglich ist, wollen wir in Analogie zu unserem Ansatz bei der Tumortherapie die T-Zellen mittels eines speziellen Rezeptors gegen CMV-infizierte Zellen richten. Ein derartiger Rezeptor, den wir in enger Kooperation mit einer Arbeitsgruppe am Institut für Virologie in Erlangen in Deutschland entwickelten, soll im nächsten Schritt präklinisch getestet werden.
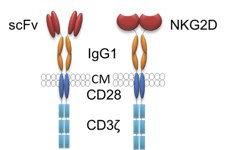
Fig. 1. Die Abbildung zeigt den Aufbau von CARs mit Antigenbindenden Domänen, welche sich entweder von Antikörpern (scFv, single chain variable region fragment, gerichtet gegen CMV-gB) oder von der extrazellulären Domäne des Rezeptors NKG2D ableiten. Die Rezeptoren enthalten eine stabilisierende IgG1 Domäne sowie die Signalübertragenden Domänen der Proteine CD3zeta und CD28 (CM, Zytoplasmamembran).
Die Therapie mittels modifizierter T-Zellen gründet auf der Tatsache, daß Immunzellen, v.a. sogenannte T-Zellen und NK-Zellen, nicht nur virusinfizierte Zellen sondern auch Krebszellen erkennen und abtöten können. Häufig entzieht sich der Tumor allerdings der Erkennung durch diese Zellen, weshalb man bereits in den 90-er Jahren weltweit mit der Erforschung von Möglichkeiten zur Auslösung einer effizienten Immunantwort gegen Krebszellen begann. Dabei verfolgte man im Wesentlichen 3 Wege:
- 1. Die Vermehrung von tumor-spezifischen T-Zellen außerhalb oder im Körper durch Nutzung von Dendritischen Zellen, welche Tumor-Antigene präsentieren und so Tumor-reaktive T-Zellen aktivieren;
2. Vermehrung von T-Zellen außerhalb des Körpers unabhängig von Dendritischen Zellen und Ausstattung mit Tumor-spezifischen Rezeptoren;
3. Umlenkung von Immunzellen im Körper durch Verabreichung von Antikörpern, die an die Krebszellen und an Immunzellen gleichzeitig binden, sowie von Antikörpern, welche bestimmte Zellinteraktionen blockieren und so die Immunantwort verstärken.
Inzwischen existiert sehr detailliertes Wissen darüber, wodurch Krebszellen in unterschiedlichen Stadien sich von gesunden Zellen unterscheiden und welche Veränderungen auf der Zelloberfläche als Angriffspunkte für eine Immunantwort dienen könnten. Dies macht man sich für die T-Zellbasierte Immuntherapie zunutze, indem man T-Zellen mit sogenannten „chimären Antigenrezeptoren“ (CARs) ausstattet, welche in T-Zellen eingeschleust werden, damit diese an Krebszellen andocken können. Für die Herstellung dieser Rezeptoren verwendet man meist Tumor-spezifische Antikörper-Fragmente, welche an die Signal-übertragenden Untereinheiten des T-Zellrezeptor-Komplexes sowie weiterer stimulierender Rezeptoren gekoppelt werden. Damit löst die Erkennung des Zielantigens eine starke Aktivierung der T-Zellen aus, was zur T-Zell-Vermehrung und zur Abtötung der Zielzellen führt.
In unserem Labor untersuchten wir das Vorkommen einer besonderen Familie von Streß-induzierten Proteinen, den NKG2D-Liganden, auf der Oberfläche von Ewing Sarkom-Zellen und anderen Sarkom-Zellen. Basierend auf unseren Ergebnissen, welche auf ein sehr häufiges Vorhandensein dieser Proteine gerade in dieser Tumor-Klasse hindeuteten, entwickelten wir einen künstlichen Rezeptor, der anstelle eines Antikörper-Fragments den extra-zellulären Teil eines natürlichen Rezeptors (NKG2D) enthält (Lehner et al. 2012). Dieses „Bauprinzip“ und die Wahl der Tumorantigene (NKG2D-Liganden) bieten möglicherweise entscheidende Vorteile hinsichtlich der Wirksamkeit der Strategie.
Für die Einschleusung unseres Rezeptors in die T-Zellen verwenden wir zwei unterschiedliche Methoden: Erstens perforieren wir die Zellmembran durch einen elektrischen Schock, wodurch mRNA in die Zellen gelangen kann; zweitens infizieren wir die Zellen mit einem vom HIV abgeleiteten Retrovirus, wodurch das für unseren Rezeptor codierende DNA-Stück in die DNA der T-Zelle einbaut wird. Durch die mRNA-basierte Methode produzieren die T-Zellen den Rezeptor nur vorübergehend, durch die Virus-basierte Methode tun sie das dauerhaft. Während die mRNA-basierte Methode einfacher umzusetzen ist, birgt die Virus-basierte Methode Chancen einer möglicherweise höheren Wirksamkeit der T-Zellen. Wir verfolgen daher beide Strategien und neuerdings auch die Möglichkeit des sogenannten Transposon-basierten Gentransfers mit dem, Ziel der Herstellung „maßgeschneiderter“ T-Zellen. Die Weiterentwicklung unserer Strategie im präklinischen Modell ist ein entscheidender Schritt Richtung klinischer Anwendung für die Therapie beim Ewing Sarkom und möglicherweise weiteren Tumoren.
Die Anwendung von Rezeptor-modifizierten T-Zellen ist nicht nur für die Therapie von Tumoren, sondern möglicherweise auch für die Therapie von Cytomegalovirus-Infektionen in Patienten nach Stammzell-transplantation interessant. Eine Besonderheit des Cytomegalovirus ist, daß intakte Virus-Proteine an die Oberfläche von infizierten Zellen gelangen. Dies macht dieses Virus für unseren Ansatz besonders angreifbar. Da wie beim Ewing Sarkom wiederum modifizierte Zellen zum Einsatz kommen sollen, ist auch hier die Testung im präklinischen Modell Voraussetzung für die klinische Anwendung. Diese CMV-gerichteten Arbeiten führen wir in enger Kooperation mit unserem deutschen Partner in Erlangen durch (Full et al. 2010).
In unserem Labor untersuchten wir das Vorkommen einer besonderen Familie von Streß-induzierten Proteinen, den NKG2D-Liganden, auf der Oberfläche von Ewing Sarkom-Zellen und anderen Sarkom-Zellen. Basierend auf unseren Ergebnissen, welche auf ein sehr häufiges Vorhandensein dieser Proteine gerade in dieser Tumor-Klasse hindeuteten, entwickelten wir einen künstlichen Rezeptor, der anstelle eines Antikörper-Fragments den extra-zellulären Teil eines natürlichen Rezeptors (NKG2D) enthält (Lehner et al. 2012). Dieses „Bauprinzip“ und die Wahl der Tumorantigene (NKG2D-Liganden) bieten möglicherweise entscheidende Vorteile hinsichtlich der Wirksamkeit der Strategie.
Für die Einschleusung unseres Rezeptors in die T-Zellen verwenden wir zwei unterschiedliche Methoden: Erstens perforieren wir die Zellmembran durch einen elektrischen Schock, wodurch mRNA in die Zellen gelangen kann; zweitens infizieren wir die Zellen mit einem vom HIV abgeleiteten Retrovirus, wodurch das für unseren Rezeptor codierende DNA-Stück in die DNA der T-Zelle einbaut wird. Durch die mRNA-basierte Methode produzieren die T-Zellen den Rezeptor nur vorübergehend, durch die Virus-basierte Methode tun sie das dauerhaft. Während die mRNA-basierte Methode einfacher umzusetzen ist, birgt die Virus-basierte Methode Chancen einer möglicherweise höheren Wirksamkeit der T-Zellen. Wir verfolgen daher beide Strategien und neuerdings auch die Möglichkeit des sogenannten Transposon-basierten Gentransfers mit dem, Ziel der Herstellung „maßgeschneiderter“ T-Zellen. Die Weiterentwicklung unserer Strategie im präklinischen Modell ist ein entscheidender Schritt Richtung klinischer Anwendung für die Therapie beim Ewing Sarkom und möglicherweise weiteren Tumoren.
Die Anwendung von Rezeptor-modifizierten T-Zellen ist nicht nur für die Therapie von Tumoren, sondern möglicherweise auch für die Therapie von Cytomegalovirus-Infektionen in Patienten nach Stammzell-transplantation interessant. Eine Besonderheit des Cytomegalovirus ist, daß intakte Virus-Proteine an die Oberfläche von infizierten Zellen gelangen. Dies macht dieses Virus für unseren Ansatz besonders angreifbar. Da wie beim Ewing Sarkom wiederum modifizierte Zellen zum Einsatz kommen sollen, ist auch hier die Testung im präklinischen Modell Voraussetzung für die klinische Anwendung. Diese CMV-gerichteten Arbeiten führen wir in enger Kooperation mit unserem deutschen Partner in Erlangen durch (Full et al. 2010).
Weitere Literaturangabe
Lehner M., B. Kellert, J. Proff, MA. Schmid, P. Diessenbacher, A. Ensser, J. Dörrie, N. Schaft, M. Leverkus, E. Kämpgen, W. Holter. Autocrine TNF is critical for the survival of human dendritic cells by regulating BAK, BCL-2, and FLIPL. J.Immunol. 2012. 188: 4810-4818.










